发布时间:2025-02-19
近日,迈威生物(688062.SH)在国际权威期刊《Journal of Experimental & Clinical Cancer Research》(中科院一区,影响因子 11.4)上发表了其自主研发的靶向整合素αvβ8抗体药物的临床前研究成果,系统阐述了该药物的作用机制。这是国内企业首次报道整合素 αvβ8 抗体药物的研究成果。

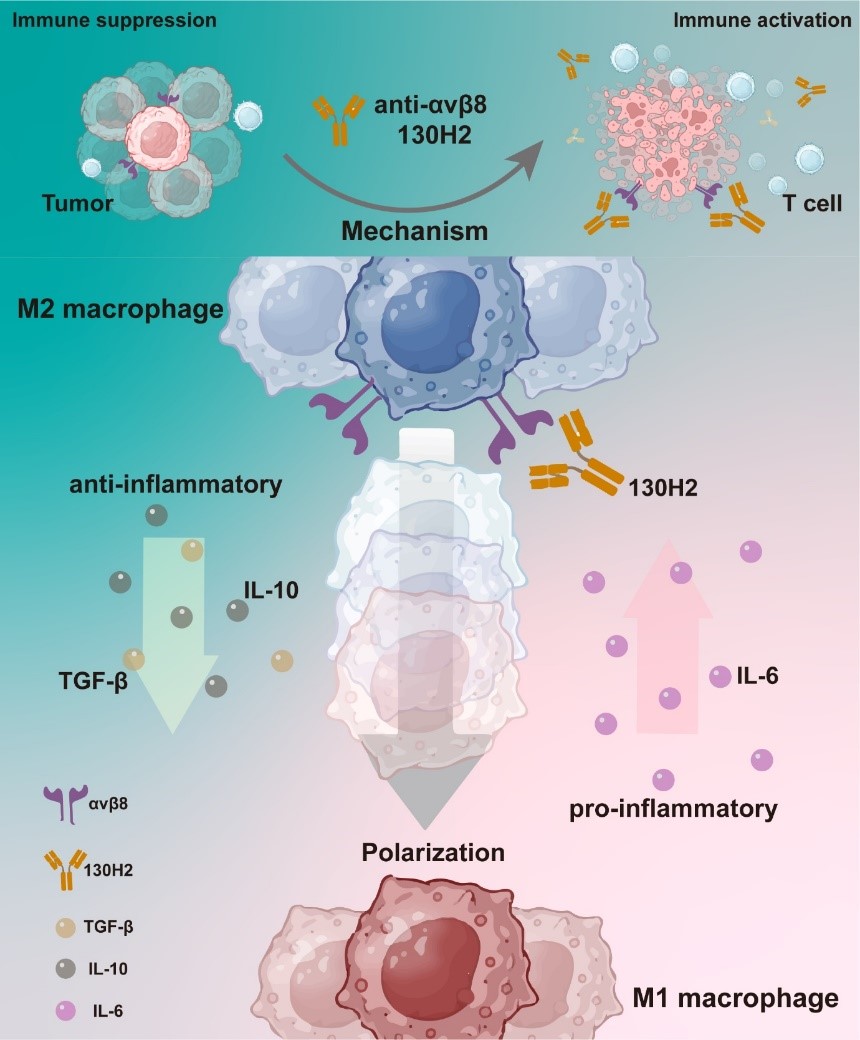
肿瘤免疫微环境可分为三种主要表型:免疫炎症型(immune-inflamed)、免疫排斥型(immune-excluded)和免疫荒漠型(immune-desert)。其中,免疫炎症型肿瘤对 PD-1 抑制剂等免疫检查点抑制剂表现出良好的治疗响应,而免疫排斥型和免疫荒漠型肿瘤则对免疫治疗反应较差。研究表明,TGF-β 信号通路的异常激活与免疫排斥型肿瘤的治疗抵抗密切相关。在高表达 TGF-β 信号通路的肿瘤中,免疫标志物的表达水平显著降低,且患者预后较差。已有研究证实,TGF-β 信号可通过抑制T细胞向肿瘤组织的浸润来削弱抗肿瘤免疫反应。然而,由于 TGF-β 具有多效性且其功能高度依赖于特定的生物学环境,针对该信号通路的系统性抑制往往伴随严重的毒副作用和有限的治疗效果。因此,将 TGF-β 抑制限制在特定的免疫抑制性肿瘤微环境中,可能比广泛抑制TGF-β 具有更好的安全性和治疗效果。
本研究通过单细胞 RNA 测序技术对多种人体肿瘤样本进行分析,发现调控 TGF-β 释放的关键分子整合素 αvβ8 在多种类型的肿瘤细胞和肿瘤浸润性巨噬细胞中均有显著表达,提示其作为潜在治疗靶点的重要价值。基于这一发现,迈威生物成功开发了 αvβ8 特异性阻断抗体 130H2。通过冷冻电镜结构解析,研究团队证实 130H2 能够特异性结合 β8亚基,而不与 αv 亚基发生相互作用。进一步研究表明,130H2 可有效抑制 TGF-β 的释放,在多种肿瘤模型中均显示出显著的抗肿瘤活性,并能够显著增加肿瘤浸润性免疫细胞(包括 CD8+ T 细胞、CD4+ T 细胞、DC 细胞和 NK 细胞)的数量。机制研究揭示,130H2 可通过诱导单核细胞向 M1 型巨噬细胞表型极化,从而激活肿瘤免疫微环境。
值得注意的是,研究发现 PD-1 抗体单药治疗对免疫排斥型肿瘤基本无效,但与 130H2 联合使用时,可显著抑制肿瘤生长。同时抑制 TGF-β 信号通路和 PD-1/PD-L1 通路能够有效逆转免疫抑制性微环境,显著提高免疫耐受型肿瘤对 PD-1 抑制剂的治疗响应。这些发现表明,αvβ8 抗体与 PD-1 抗体的联合应用策略有望显著提升 PD-1 抑制剂的临床响应率,为肿瘤免疫治疗提供了新的研究方向。